Es el término utilizado para describir trastornos pulmonares como asma, bronquitis crónica y enfisema.
El término EPOC es preferible al de Enfisema o Bronquitis crónica por que engloba a éstos y describe mejor la enfermedad obstructiva que se observa en los fumadores.
ASPECTOS FISIOPATOLOGICOS
• Es una patología caracterizada por una obstrucción al flujo aéreo espiratorio.
• Esta alteración se cuantifica por medio de estudios espirométricos, en los que se llevan a cabo maniobras espiratorias forzadas, partiendo de la capacidad pulmonar total (CPT). Se miden dentro del estudio: el volumen espiratorio forzado en el primer segundo (VEF1), la capacidad vital forzada (CVF) que es la cantidad total de aire espirado durante toda la espirometría y el cociente entre VEF1/CVF.
• En los pacientes EPOC se observa una disminución del VEF1 y una disminución del cociente VEF1/CVF a largo plazo.
• La disminución del VEF1 no mejora con la administración de broncodilatadores, lo que constituye un diagnóstico diferencial con el asma.
¿Cómo se desarrolla a enfermedad pulmonar obstructiva crónica o EPOC?
Esta enfermedad puede desarrollarse en cualquiera de estos puntos anatomicos, ya que, es una patología caracterizada por una obstrucción al flujo aéreo espiratorio.
En la EPOC se producen distintos fenómenos patológicos en cinco puntos anatómicos, resultando en varias manifestaciones clínicas:
· Bronquitis crónica: Inflamación crónica de vía aérea que conduce a hipersecreción mucosa con tos productiva crónica.
· Bronquiolitis obstructiva:Inflamación de vía aérea pequeña que provoca fibrosis y remodelado conduciendo a obstrucción de vía aérea.
· Enfisema: Debido a destrucción proteolítica con remodelado debronquiolos y alvéolos.
· Enfermedad vascular pulmonar ycor pulmonale: Por destrucción de lecho capilar pulmonar causandohipertensión arterial pulmonar e insuficiencia cardíaca derecha. Esta patología se conoce como cor pulmonale.
· Enfermedad sistémica: En caso de EPOC avanzada hay inflamación extrapulmonar con caquexia y perdida de masa magra con debilidad muscular.
¿Quienes pueden desarrollar esta enfermedad?
El enfisema y la bronquitis crónica afectan a aproximadamente 16 millones de personas en los Estados Unidos, o cerca del 11 por ciento de la población.
Actualmente, la EPOC afecta a millones de personas en los Estados Unidos, causando más de 100,000 muertes cada año. En más del 80% de los casos, la enfermedad está relacionada con el hábito de fumar.
En Andalucía (1995-96)
· Fue la tercera causa de muerte en la población mayor de 65 años y la sexta causa entre 15 y 64 años.
· Fue uno de los primeros diez GDR.
· Generó 6.425 ingresos en 1995 y 6.288 en 1996. Casi el 70% correspondía a mayores de 65 años.
· El consumo de broncodilatadores y mucolíticos sobrepasó los nueve mil millones de pesetas.
¿Cuáles son sus causas y Consecuencias?
La relación entre el tabaco y la EPOC ha sido comprobada más allá de toda duda razonable y es la causa más determinante en el desarrollo de la enfermedad. Los fumadores susceptibles (alrededor de un 15%) presentan una pérdida acelerada del FEV por año (unos 40-100 M1 frente a los 20-30 ml/año de los no fumadores) y existe además una relación con la cantidad de tabaco consumido.
El humo del cigarrillo la causa EPOC irritando las vías aéreas y creando la inflamación que estrecha las vías aéreas, haciendo más difícil respirar. El humo del cigarrillo también hace que los cilios paren de funcionar correctamente así que el moco y las partículas atrapadas no se limpian de las vías aéreas. Consecuentemente, la tos y la producción crónica del moco en exceso se desarrollan, lo que lleva a la bronquitis crónica.
La exposición laboral que presenta evidencias de relación causal con la EPOC incluye el cadmio, sílice y polvos inorgánicos. La polución ambiental o doméstica, aunque ha sido invocada y discutida, es un factor menos claro y al menos muy pequeño en comparación con el tabaco.
En alguna gente, la bronquitis y las infecciones crónicas pueden conducir a la destrucción de las vías aéreas pequeñas, o al enfisema.
El segundo factor más comprobado son los déficit graves de alfa 1-antipripsina (ATT), que asociados con el fenotipo PiZZ es un importante factor en la producción de enfisema. De todas formas, estos casos suponen una parte muy pequeña de los pacientes con EPOC.
La deficiencia de AAT, un desorden heredado, que también puede conducir al enfisema. La antitripsina alfa-1 (AAT) es una sustancia protectora producida en el hígado y transportada a los pulmones para ayudar a combatir la inflamación. Cuando no hay bastante del producto químico AAT, el cuerpo ya no está protegido contra una enzima en las células blancas de la sangre. Esto puede causar una brecha en las paredes de los sacos del aire (alvéolos). Cuando se destruyen los alvéolos, el oxígeno no se puede transferir a la sangre y el bióxido de carbono no se puede tomar de la sangre ni expirarlo.
El papel de las infecciones respiratorias en la EPOC se encuentra aún bajo investigación. Algunas infecciones virales (virus sincitial y adenovirus) han sido señaladas como culpables de provocar síntomas crónicos o alteración en la función. La evidencia apunta a una relación causal entre las infecciones en la primera infancia y una disminución de la función pulmonar en la edad adulta.
La prevalencia es mayor en varones, aunque en países en los que el tabaco tiene ya larga historia entre las mujeres el riesgo parece ser equivalente. Factores hereditarios parecen tener alguna importancia al igual que la raza; parece que el riesgo de EPOC es menor entre los negros, latinoamericanos y asiáticos, aunque la mayor parte de estos datos se refieren a población americana.
Posiblemente puedan contribuir una serie de factores, algunos no bien conocidos, aunque el papel del tabaco parece determinante. El porqué la mayoría de los fumadores (85%) no desarrollan EPOC sigue siendo un problema apasionante y mal aclarado.
Clasificación de Gravedad de EPOC
Para valorar la gravedad del EPOC teniendo en cuenta la presencia de síntomas y el valor de la espirometría.
Se los divide en estadios o etapas:
• Estadio I (leve): la espirometría demuestra un cociente VEF1/CVF menos al 70%, y un VEF1 menor al 80% del predicto (valor que se espera obtener para ese paciente), con o sin presencia de tos y expectoración.
• Estadio II (moderado): donde el cociente VEF1/CVF es menor al 70% y el VEF1 esta entre el 50-80% del predicto. Puede tener o no tos y expectoración.
• Estadio III (grave): donde el coiente VEF1/CVF tambien es menor al 70% pero el VEF1 esta entre el 30-50% del predicto. Puede presentarse o no con sintomas como tos, expectoración y disnea.
• Estadio IV (Muy grave): el cociente VEF1/CVF es menor al 70% y el VEF1 es menor al 30% del predicto, siempre pudiendo estar presentes o no, los síntomas como tos y expectoración. Este estadio tambien puede considerarse si el cuadro se presenta con una espirometría en la cual el VEF1 es entre 30-50% del predicto pero el sujeto presenta signos de insuficiencia respiratoria o de insuficiencia del hemicardio derecho (en caso de cor pulmonae asociado)
Otra alteración característica que sufre el paciente con EPOC es la hiperinsuflación del tórax durante la fase ventilatoria.
La corriente espiratoria máxima está conservada y al aumentar el volumen pulmonar se incrementa la presión de retroceso elástico y se ensanchan las vías respiratorias, lo que disminuye la resistencia aérea.
Por un lado, la hiperinsuflación es útil para compensar la obstrucción. Sin embargo, una insuflación excesiva produce:
• Descenso y aplanamiento del diafragma, horizontalización de las costillas, ensanchamiento de espacios intercostales, e hiperclaridad pulmonar.
• Todos fenómenos visibles a radiografía de tórax.
¿Cuáles son los Síntomas de la enfermedad pulmonar obstructiva crónica o EPOC?
• Al principio de la enfermedad pueden no existir síntomas.
Luego se comienzan a expresar:
• Tos con o sin flema
• Fatiga
• Muchas infecciones respiratorias
• Dificultad respiratoria (disnea) que empeora con actividad leve
• Dificultad para tomar aire
• Sibilancias
• Prolongación de la fase espiratoria (tarda más en expulsar el aire)
• Sibilancias espiratorias
• Hiperinsuflación del tórax también denominado tórax en tonel.
• Utilización de los músculos accesorios de la respiración.
• Cianosis (coloración azulada) en labios y lecho ungueal.
• Reducción notable del peso.
• Pérdida del tejido adiposo subcutáneo.
Se denomina a los enfisematosos “soplador rosado” y a los bronquíticos crónicos “abotagado azul”
¿Cómo se diagnostica la enfermedad pulmonar obstructiva crónica o EPOC?
El diagnóstico de la EPOC es normalmente fácil al detectar una obstrucción poco variable tras haber descartado otros procesos. Si este tipo de obstrucción se da en un individuo por encima de la media de edad de vida, con síntomas variables de tos, expectoración y antecedentes de fumador durante largos años, el diagnóstico está claramente establecido.
Clínica y exploración física
La historia de fumador, la tos y la expectoración crónicas, preferentemente matutina, las infecciones Recurrentes con aumento de síntomas preferentemente invernales y la disnea progresivamente creciente son los
Síntomas más constantes de la EPOC. En ocasiones para el paciente no es fácil distinguir una reagudización de Sus síntomas habituales pues acostumbran a decir que siempre están acatarrados; el aumento del esputo, su Mayor viscosidad y aspecto purulento y el aumento de la disnea parecen caracterizar mejor los brotes, aun que no Existan otros síntomas de catarro nasal o fiebre acompañantes.
La persistencia de una abundante expectoración (por encima de 30 ml en 24 horas) puede hacernos sospechar la existencia de bronquiectasias asociadas, aunque la medida de la cantidad de esputos es una práctica poco común en nuestro medio. La expectoración homoptoica, aunque puede presentarse a veces acompañando a las reagudizaciones, debe hacernos descartar otras patologías y en especial el carcinoma bronquial, cuya incidencia está claramente aumentada en este tipo de pacientes. Por otro lado no existe evidencia de que en la EPOC se dé con mayor frecuencia la asociación con el síndrome de apnea obstructiva durante el sueño (SAOS) ("síndrome overlap"); la sospecha de un SAOS asociado a un EPOC puede derivarse de una sintomatología evocadora que debe indagarse sobre todo en los EPOC obesos y somnolientos, o por la aparición de policitemia o cor pulmonale en pacientes con PaO2 mayor de 60mm de Hg; en estos casos puede estar indicado un estudio polisomnográfico durante el sueño y estudiar el posible beneficio de tratamiento con CPAP durante las horas nocturnas.
Los signos de exploración física en la EPOC suelen ser muy poco expresivos en la enfermedad leve/moderada. Una espiración alargada y la aparición de sibilantes pueden ser signos de obstrucción no específicos. Sólo la disminución de los sonidos pulmonares parecía relacionarse con un FEV1/FVC% menor del 60%. Signos como la cianosis, actividad de la musculatura accesoria, signos de insuficiencia cardíaca derecha con edemas, pueden aparecer en la enfermedad grave y preferentemente en el fallo respiratorio agudo en las agudizaciones catarrales de importancia; en estas últimas puede aparecer un movimiento incordinado de la caja torácica o respiración paradójica de la pared abdominal durante la inspiración, que puede indicamos una situación más crítica y de mayor trabajo mecánico, aunque no se corresponde de forma estrecha a una situación de fatiga muscular como hasta hace bien poco se creía. La asterixis y el nivel de relación y coherencia nos pueden indicar la existencia de hipercapnia. El sobrepeso y la obesidad pueden acompañar a la EPOC , empeorando la disnea y la eficacia de la musculatura respiratoria, aunque valores claramente por debajo de su peso ideal también son corrientes en algunos casos de enfermedad grave con tipo clínico de enfisema. Tanto la SEPAR como la ERS no hacen hincapié en separar las formas clínicas de los pacientes sonrosados sopladores, delgados y luchadores, con gran insuflación y disminución de ruidos pulmonares, y en general no hipercápnicos (pink puffers) de los "blue bloaters", obesos, congestivos, y cianóticos, hipoventiladores y con frecuente fallo derecho; posiblemente en
términos generales lleven razón pues muchos pacientes tienen rasgos mal definidos y en ambos grupos hay enfisema en sus pulmones; de todas formas en sus cuadros extremos podría tener algún interés, pues los "blue bloaters" por ejemplo tienen mayores riesgos de hipoventilación y retención de CO2 si se les suministran sedantes u O2 a altas concentraciones, son más susceptibles a sufrir trombosis venosa por policitemia y aparición de cor pulmonale; en los "pink puffers" el abordaje con más énfasis de la disnea, la corrección de su bajo peso ponderal o la posibilidad de plantear cirugía de reducción de volumen podría servir en alguna circunstancia.
Examen radiológico
Es habitual el examen radiológico del tórax en proyecciones posteroanterior y- lateral en la evaluación del paciente con EPOC y obligado en las agudizaciones, aunque no es útil para valorar la obstrucción al flujo aéreo. La radiotransparencia, la atenuación vascular y la hiperinsuflación (horizontalización de diafragmas y aumento de cámara retroestiernal) pueden indicar la existencia de enfisema. En casos avanzados pueden encontrarse signos de hipertensión pulmonar o aumento de cavidades derechas en algunos pacientes. En ocasiones, la Rx nos sirve para sospechar la existencia de un carcinoma broncopulmonar o para confirmar o descartar la existencia de una neumonía o un neumotórax durante un episodio de empeoramiento.
La tomografía computarizada (TC) es más sensible y precoz para ver el daño y la extensión del enfisema pero su uso en relación al costo/beneficio no está indicado en la rutina clínica. Debemos reservarlo para el estudio prequirúrgico de resección de grandes bullas, en cirugía de reducción pulmonar o de trasplante, o para el diagnóstico de bronquiectasias añadidas.
Pruebas de función pulmonar
La espirografía es básica tanto para el diagnóstico como para el seguimiento de la EPOC. La espirografía, sin embargo, debe de hacerse con utillaje bien establecido y por personal muy entrenado.
Aunque la difusión de la espirometría tiene interés en la atención primaria, sino está suficientemente estandarizada y cumple los criterios exigidos, puede crear más problemas que los que supuestamente soluciona, además de su coste.
Las alteraciones espirográficas asociadas con la EPOC consisten en una reducción del FEV1 y de su relación con la capacidad vital o FEV1/FVC%.
El FEV1 constituye una expresión simple de un fenómeno complejo; es una función de la retracción elástica pulmonar y del tórax, y del grado de apertura de las vías aéreas. El FEV1 se modifica por la pérdida de retracción elástica (como en el enfisema), por el estrechamiento de la vía aérea, o por ambas situaciones, como en una buena parte de los pacientes con EPOC. El FEV1/FVC% es un buen índice en las fases no evolucionadas de la enfermedad, siendo preferible para estas últimas la expresión como FEV1 en % de sus valores de referencia. Los medidores de flujo máximo tienen un escaso papel en el diagnóstico o seguimiento de la EPOC , y falsamente engañosos en la enfermedad grave, aunque en ocasiones se utilizan para monitorizar de forma aproximada la evolución tras un brote agudo o en el área de urgencias, aunque en este último caso casi estamos controlando más factores de debilidad muscular, pues los flujos máximos son muy dependientes del esfuerzo.
Basados en los valores del FEV1 se suele dividir la gravedad de la EPOC , aunque según las distintas normativas estos límites no son totalmente equivalentes.
Las espirografías practicadas tras la administración inmediata de broncodilatadores, tras pautas terapéuticas de mayor duración a lo largo del proceso tienen interés. De todas maneras una prueba de broncodilatación inmediata negativa no debe hacemos eliminar los broncodilatadores en el tratamiento, siendo preciso ver su evolución a más largo plazo. La expresión de la mejoría se debe hacer en tantos por ciento de los valores predichos, evitando así la dependencia de los valores basales, especialmente distorsionantes (aparente gran variación) cuando se parten de valores basales muy bajos. Variaciones de un 10% en el FEV1 ó de 200lm] en valores absolutos podrían ser tomadas como significativas. Hay que considerar también en algunos casos el beneficio sintomático aún sin modificaciones en el FEV1.
Gasometría arterial
Tanto en la evaluación inicial de los pacientes moderados/severos, como en el fallo respiratorio agudo que acompaña a algunas agudizaciones, son precisas la determin ación de gasometrías arteriales, e incluso de forma repetida en el segundo caso en pacientes que precisan hospitalización. Asimismo son necesarias para establecer, revisar y establecer las indicaciones de oxigenoterapia domiciliaria continua.
Otras valoraciones funcionales
Pruebas de ejercicio
En la EPOC es habitual una disminución de la capacidad de ejercicio incluso en fases no avanzadas de la enfermedad. Sus causas son múltiples pues influye sin duda la limitación mecánica ventilatoria y la disminución de la reserva respiratoria, pero la debilidad muscular general y de extremidades y factores vasculares de hipertensión pulmonar, etc., también contribuyen; la repercusión sobre el músculo de sus alteraciones gasométricas e incluso el tratamiento crónico con esteroides y la posible inducción de miopatías tampoco parece ser desdeñable. En la enfermedad grave se produce un verdadero círculo vicioso, pues los pacientes disminuyen su actividad por miedo a la disnea, lo que les ocasiona un descondicionamiento muscular y mayor disnea e incapacidad para actividades cada vez más pequeñas.
Se pueden plantear estudios de test de ejercicios con las siguientes finalidades: 1) en la valoración del proceso y en el estudio de una desproporción subjetivo/funcional. 2) en el planteamiento, ejecución y control de un programa de rehabilitación respiratoria, para lo que es fundamental e imprescindible. 3) en la valoración de las indicaciones de oxigenoterapia durante el ejercicio con sistemas de oxígeno portátil. 4) en la valoración de la aptitud y capacidad laboral de los pacientes. 5) en el seguimiento y control de respuesta ante medidas terapéuticas diversas. 6) en la evaluación preoperatoria de un paciente que va a ser sometido a cirugía pulmonar por carcinoma y con valores dudosos espirométricos, o en los casos que se plantee cirugía reductora o de trasplante.
La valoración del ejercicio según su intención puede consistir en pruebas de esfuerzo máximas y progresivas en tapiz rodante o bicicleta ergométrica, con control de consumo de gases y múltiples controles o por el contrario test sencillos de paseo del corredor, de los que el test de los 6 ó 12 minutos son los má utilizados y en los que sólo se controlan los metros recorridos con controles sencillos de disneas mediante escalas, HR y en ocasiones SaO2; el shuttle walking test es también de escasa complejidad, pero más estandarizado, progresivo y en escalones, y con una posible mayor aplicabilidad en rehabilitación domiciliaria.
Estudios de los músculos
Este tipo de estudios está especialmente indicado en el campo de la rehabilitación mediante técnicas de presiones musculares, respiratorias máximas y medida de la fuerza máxima y posible debilidad de las extremidades superiores e inferiores. Estudios más cruentos o sofisticados caen dentro del campo de la investigación.
Estudio de la disnea y la calidad de vida
La disnea es el síntoma capital de los pacientes con EPOC. Se pueden valorar mediante escalas con grados simples o mediante índices poco más complejos, en los que como en los de Mahler, se tiene en cuenta no sólo las tareas que producen la disnea, sino el grado de esfuerzo que desarrolla y el posible deterioro funcional (BDI o baseline dyspnea index; TDI o transition dispnea index). La escala modificada de Borg u otras analogías visuales simples se han incorporado a la valoración durante el ejercicio y están suficientemente validadas.
Dada la poca relación existente en ocasiones entre los síntomas y la repercusión sobre su vida y por otro el grado de deterioro funcional, en los últimos años se ha desarrollado mucho el estudio de la calidad de vida en relación a la salud en este tipo de pacientes. Los cuestionarios específicos desarrollados para la EPOC parecen ser útiles y más sensibles a los cambios que otros cuestionarios genéricos que también se han utilizado ypueden aplicarse en otro tipo de procesos no pulmonares. Tanto el Chronic Respiratory Disease Questionnaire (CRDQ) de Guyatt, como el Saint George Respiratory Questionnaire (SGRQ) de Jones estan bastante estudiados, tanto respecto a su fiabilidad como a su consistencia interna, como a su validez y sensibilidad a los cambios. Para su utilización en otra lengua es preciso un proceso metodológico y de validación previa que está hecha en español para el CRDQ y preliminarmente para el St. George. Recientemente un grupo de trabajo sobre "Calidad de Vida y EPOC" promovido por SEPAR y en el que he participado, ha publicado una monografía sobre este tema, con la intención de dar a conocer y divulgar los cuestionarios de calidad de vida más importantes y conocidos. De todas formas, salvo los cuestionarios autocumplimentados y los más breves, esta metodología no es de fácil aplicación en la práctica clínica diaria; su uso en proyectos de investigación terapéutica se ha hecho sin embargo práctica casi obligada.
En pocas palabras eeste es un resumen de como se diagnostica esta enfermedad y de como se dividen cada uno de los diagnosticos:
Historial médico
Para diagnosticar EPOC, el médico necesita que contestes las siguientes preguntas:
• ¿Usted fuma?
• ¿Usted ha tenido exposición crónica al polvo o a los agentes contaminantes del aire?
• ¿Otros miembros de su familia tienen enfermedad del pulmón?
• ¿Tiene dificultad para respirar?
• ¿Usted tiene dificultad para respirar cuando hace ejercicio?
• ¿Usted tiene tos crónica y/o resuello?
• ¿Usted tose con exceso de moco?
Examen físico
Para ayudarse con el diagnostico, el médico conducirá un examen físico cuidadoso que incluye:
• El escuchar tus pulmones y tu corazón
• Comprobar tu presión arterial y pulso
• Examinar tu nariz y garganta
• Comprobar tus pies y tobillos para saber si hay hinchazón
Laboratorio y otras pruebas
Varios exámenes de laboratorio y otras pruebas son necesarios para confirmar un diagnostico de EPOC. Estas pruebas pueden incluir:
• Electrocardiograma (ECG o EKG) para comprobar la función del corazón y para descartar una enfermedad cardiaca como causa de la dificultad respiratoria.
• Radiografía del pecho para buscar los cambios del pulmón que se podrían causar por EPOC.
• Espirometría y pruebas de función pulmonares (PFTs) para determinar la capacidad pulmonar y el flujo de aire
• Oximetría de pulso para medir la saturación del oxígeno en la sangre
• Gases de sangre arteriales (por sus siglas en inglés ABGs) para determinar la cantidad de bióxido de carbono y de oxígeno en la sangre
• Prueba de ejercicio para determinar si el nivel del oxígeno en la sangre cae durante el ejercicio
Varios exámenes de laboratorio y otras pruebas son necesarios para confirmar un diagnostico de EPOC. Estas pruebas pueden incluir:
• Electrocardiograma (ECG o EKG) para comprobar la función del corazón y para descartar una enfermedad cardiaca como causa de la dificultad respiratoria.
• Radiografía del pecho para buscar los cambios del pulmón que se podrían causar por EPOC.
• Espirometría y pruebas de función pulmonares (PFTs) para determinar la capacidad pulmonar y el flujo de aire
• Oximetría de pulso para medir la saturación del oxígeno en la sangre
• Gases de sangre arteriales (por sus siglas en inglés ABGs) para determinar la cantidad de bióxido de carbono y de oxígeno en la sangre
• Prueba de ejercicio para determinar si el nivel del oxígeno en la sangre cae durante el ejercicio
¿Cuáles son los tratamientos de la enfermedad pulmonar obstructiva crónica o EPOC?
TRATAMIENTO
Los objetivos del tratamiento de la EPOC deben centrarse en mejorar la sintomatología de los pacientes, evitar en lo posible su deterioro progresivo y las complicaciones, mejorar lo más posible su función pulmonar y las limitaciones que les ocasiona para su vida laboral y cotidiana y en definitiva, mejorar su calidad de vida en relación a la salud.
Dejar de fumar
Dejar de fumar debe de ser la mayor prioridad en el cuidado de los pacientes con EPOC y supone la terapéutica más importante en todos los estadios y grados evolutivos de la enfermedad.
El beneficio más rápido al dejar de fumar es la reducción de la tos y de la producción de esputos. Los trabajos iniciales ya clásicos de Fletcher y Coll demostraron que los fumadores susceptibles que perdían rápidamente el FEV1 tras dejar de fumar, la pérdida por año ulterior se aproximaba a la de los no fumadores y dichos sujetos aumentaban sus expectativas de vida. Esto ha sido confirmado posteriormente, incluso recientemente en el importante estudio multicéntrico de Salud Pulmonar realizado sobre casi 6.000 pacientes.
La forma más contrastada y útil para ayudar a dejar de fumar es la terapia substitutiva con nicotina (TNS).
Se emplean chicles o parches, aunque también se está utilizando la vía inhalatoria. Respecto a los chicles hay datos que sugieren una mayor eficacia cuando se utilizan a dosis más altas (chicles de 4 mg frente a los de 2mg)". Los parches también son eficaces y no parecen haber muchas diferencias entre los de 16 y 24 horas.
Aunque el tiempo de tratamiento con nicotina no ha sido definitivamente definido, no parecen ser necesarias terapias más allá de las ocho semanas.
Los resultados de los distintos programas, a pesar de su valor, no dejan de ser un poco decepcionantes: de un 22% de media a los 6 meses con parche y de un 22% de abstinencia a los 5 años con un programa intensivo de 12 sesiones, incluyendo al consorte y utilizando chicles de nicotina. Queda mucho por hacer para mejorar estas espectativas, que a pesar de ello son bastante mejores que los intentos solitarios que suelen estar por debajo del 5% de resultados positivos. El estudio más extendido de parches más chicles repartidos según necesidades, o el tratamiento con nicotina y soporte psicológico especializado, etc., quizá lleguen a mejorar los resultados. Debemos considerar la nicotina como una verdadera droga que crea unos mecanismos y dependencia verdaderamente fuertes.
Ante la situación citada es oportuno analizar las voces que se alzan frecuentemente, de no ofertar otros tipos de tratamientos (rehabilitación, oxigenoterapia, ventilación no invasiva, etc.,) a los pacientes con EPOC que sigan fumando. Con todo el respeto y la prudencia necesaria no podemos asumir esas posiciones y sería bueno preguntar a sus defensores si extenderían esa postura a la aptitud a adoptar frente al fallo respiratorio agudo de sus pacientes. Es fundamental que el paciente deje de fumar y lo debemos ayudar para intentarlo una y mil veces si fuera preciso, pero también es cierto que nuestros métodos no tienen unos resultados muy brillantes y hay sujetos que desean el abandono y a pesar a veces de una situación a veces lamentable no son capaces o recaen con facilidad.
Por otro lado los programas sencillos de consejo médico y soporte de nicotina a nivel de atención primaria, aunque muestran resultados alrededor al 8-10% debemos analizarlos positivamente, valorando que ese porcentaje
de fumadores nada despreciable deja el tabaco de una forma sencilla.
TRATAMIENTO SINTOMÁTICO Y REHABILITADOR
Broncodilatadores
Los broncodilatadores son el tratamiento sintomático más habitual y empleado en el manejo de la EPOC.
Los agentes más utilizados son los B2 estimulantes (salbutamol, terbutalina, fenoterol, procaterol, etc,.) y los anticolinérgicos (bromuro de ipatropio). Ambos tipos de agentes tienen su lugar e interés en el manejo de la EPOC y ambos utilizados por vía inhalada, en presurizadores unidosis o aplicadores de polvo seco.
No hay datos concluyentes de que los beta estimulantes modifiquen la historia natural de la enfermedad y el
estudio de Salud Pulmonar, tampoco se ha demostrado que el bromuro de ipatropio en pacientes con obstrucciones leves poco sintomáticas, cambie la evolución del FEV1 a lo largo de cinco años frente al placebo, aunque mientras se tomaba producía su efecto broncodilatador. Por todo lo dicho no tenemos argumentos para pregonar el uso continuado de broncodilatadores en casos leves, salvo de forma temporal en las reagudizaciones.
En pacientes más sintomáticos son totalmente necesarios para aliviar los síntomas y la ERS propone a ambos grupos a un nivel de igualdad y propugnan utilizar uno u otro y cambiar o combinar según respuesta. La ATS y la SEPAR basándose en la literatura y revisiones más actualizadas destacan algunas ventajas del ipatropio y su buena tolerancia en la EPOC. Los efectos broncodilatadores anticolinérgicos sin embargo en el asma son menos potentes que los beta estimulantes.
Una parte de los pacientes moderados y la gran mayoría de los severos van a necesitar el uso de varios tipos de agentes y hay datos recientes en la literatura de que su uso combinado puede tener algún beneficio adicional a la utilización de un sólo agente por separado. Ambos podrían ser pautados cada 6 horas y utilizar el beta adrenérgico rápido como broncodilatador de rescate usándolo repartido en el día según necesidades.
Su uso combinado en único presurizador puede ser de interés, facilitar la utilización y abaratar los costes.
Aunque la mayoría de los trabajos con ipatropio han utilizado dosis habituales (2 puff cada 6 horas), dosis mayores de hasta 8 pulverizaciones por aplicación parecen tener interés, mejorando la respuesta de algunos pacientes que no la obtendrían con dosis más bajas. Los presurizadores y aplicadores deben ser utilizados correctamente y deben comprobarse las maniobras tanto como su uso en todos los pacientes, para lo que son útiles las consultas de enfermería entre otras funciones. La utilización de cámaras de inhalación puede aconsejarse en ocasiones, cuando haya dificultad en comprender las maniobras habituales y quizás aumenten algo su depósito en vías aéreas. Que el paciente se aplique los inhaladores sigue siendo un problema y suele sobrestimar su uso, frente a cuando controlamos su uso pesando los sistemas o aún más cuando son controlados mediante marcadores de dosis. Es una constatación clínica habitual que estos pacientes tengan en su caso 4 ó 5 inhaladores diferentes (mandados por el especialista, médico de familia, urgencias etc.,) o incluso alguno repetido con distinto nombre; todo esto complica mucho la cumplimentación y es mejor tener dos inhaladores claramente contrastados y explicando su distinta sensación subjetiva inmediata y retirar el resto; debemos valorar la poca comprobación de eficacia que hasta ahora conocemos de los corticoides inhalados en la EPOC y éste suele ser uno de los múltiples inhaladores mandados. También, aunque no hay estudios, parece razonable elevar la dosis de ipatropio y darlo cada 8 horas en algún caso, si creemos que vamos a facilitar su cumplimentación.
Los broncodilatadores de larga duración (salmeterol y formoterol) parecen claramente prometedores (de uso cada 12 horas) aunque su papel y utilización no está suficientemente contrastada en la EPOC , al menos con mucha menos literatura que en el caso del asma; un reciente trabajo mostraba mejoras de la calidad de vida tras el uso del salmeterol. Tanto estos productos como los nuevos anticolinérgicos, algunos aún en fase de investigación para su uso cada 12 ó 24 horas, los hace más cómodos para el paciente y facilita mucho el cumplimiento del tratamiento.
El tercer grupo de broncodilatadores son las metilxantinas. Son broncodilatadores útiles, se administran por vía oral, en presentaciones de liberación sostenida cada 12 ó 24 horas y en dosis de 12 mg/Kg/día. La
cumplimentación es fácil y los pacientes son fieles a estos productos. Sin embargo presentan algunas dificultades de manejo: mayor presentación de efectos secundarios, estrecho margen de acción, su interferencia con otras medicaciones habituales, aconsejable su control plasmático al menos en su introducción, etc. Los americanos las han utilizado profusamente, pero su uso tiene una tendencia descendente en la mayor parte de los países.Se han invocado por algunos las ventajas que presentan las metilxantinas por sus otros efectos de estimulantes respiratorios, efecto inotrópico positivo, efecto diurético, mejoría de la función diafragmática, etc, pero dudamos que éste sea un argumento suficiente para su uso. En general todas las recomendaciones y normativas asignan la utilización de metilxantinas. A los casos que no sean controlados suficientemente por el ipatropio y los beta miméticos. En esa situación, frecuente por otro lado en estadios avanzados, parece aconsejable su uso y existen algunos datos de que su empleo conjunto pueda tener algunos efectos aditivos.
Corticoides
Sólo un 10 ó 20% de los pacientes con EPOC parecen responder en alguna medida a los corticoides en situación estable. Una pauta de tratamiento de prueba para ver eficacia puede ser aconsejable. Aunque existen pocos trabajos suficientemente controlados y randomizados, algunos, incluso uno muy reciente, parecen demostrar alguna utilidad para su uso en las reagudizaciones ambulatorias en la EPOC , consiguiendo una mejoría gasométrica, de los flujos y de la disnea más rápida. En cuanto a la dosis, se puede iniciar un tratamiento de 30-40 mg de prednisona o equivalentes (deflazacort)/día, durante dos semanas, monitorizando sus efectos y posibles beneficios. Posteriormente en caso de haberlos introducido, se propone de forma empírica ir disminuyendo la dosis progresivamente cuando sea posible, hasta llegar a retirar y reservar para las reagudizaciones, o al menos llegar a la más baja posible y días alternos. Los efectos secundarios del tratamiento prolongado con corticoides son bien conocidos: sobrepeso, debilidad muscular y producción de miopatías secundarias, diabetes o empeoramiento de la misma, osteoporosis, lesiones gástricas, lesiones de fragilidad capilar cutánea, favorecer y empeorar las lesiones oculares y cataratas, trastornos psiquiátricos, etc.; siempre deben ser sopesados suficientemente.
Respecto a los corticoides inhalados en la EPOC , es frecuente su uso en la práctica clínica, aunque su utilidad sigue siendo controvertida y poco establecida. Algunos han sugerido que podría estabilizar la pérdida de
FEV1 por año, aunque la mayor parte y más recientes no demuestran ese efecto. Habrá que esperar los estudios europeos multicéntricos y con participación de varios países, que están en marcha y bastante avanzados, para que podamos aclarar más este punto.
Antibióticos y vacunaciones
Los antibióticos son recomendables en las agudizaciones catarrales con cambio del aspecto purulento del esputo. Antibióticos de primera línea, sencillos y baratos pueden ser suficientes para los gérmenes más habitualmente implicados: Estreptococo, Haemophilus influenzae, Moraxella catarralis. Dado el aumento de resistencias, y según el medio en el que se empleen, pueden utilizarse como alternativas: la amoxicilina/clavulánico, cefasporinas orales, macrólidos o incluso quinolonas. Algunos de los nuevos antibióticos son más cómodos para el paciente, menor número de dosis/día, mayor duración, etc, pero debemos tener en cuenta siempre aspectos de coste/beneficio.
El tratamiento profiláctico con antibióticos no está recomendado, aunque como excepción que no asumimos, la Sociedad Australiana lo propone en los pacientes de más de cuatro agudizaciones catarrales por año.
La vacunación antiinfluenza (antigripal) es recomendada anualmente en el otoño. La ATS aconseja también la vacunación antineumocócica, aunque este punto está menos establecido.
Rehabilitación respiratoria
Junto con dejar de fumar y el tratamiento broncodilatador, posiblemente sea la medida más útil de tratamiento en pacientes moderados/severos. Existe un acuerdo casi unánime de que la rehabilitación produce una mejona en la calidad de vida de estos pacientes.
Los programas con ejercicio físico son los más contrastados en cuanto a beneficioy usualmente ejercitan las extremidades inferiores (andar, bicicleta ergométrica, tapiz etc.). El asociar entrenamiento de extremidades superiores parece ayudar al paciente a realizar algunas tareas en las que presentaban disnea importante al utilizar grupos musculares que habitualmente ya usaban como musculatura respiratoria accesoria) y cada vez más forma parte del programa de rehabilitación, aunque su utilidad y beneficio está menos contrastada que la de extremidades inferiores.
Los pacientes a los que debe ofertárseles rehabilitación es a los que presentan una repercusión negativa por síntomas en su vida laboral o cotidiana y presumiblemente no hay que esperar a estadios muy evolucionados de la enfermedad, que era la indicación clásica. Los programas deben incluir educación al paciente y a la familia sobre la enfermedad y su correcto tratamiento. La utilidad de incluir técnicas de entrenamiento muscular respiratorio (con resistencias en la boca o con sistemas de umbral de presión), aunque muy empleada de forma añadida al ejercicio en muchos centros, ha sido cuestionada y además exige el control del patrón respiratorio lo que añade algo más de complejidad a técnicas en principio de fácil manejo por el paciente. Aún más dudas plantea el empleo de la clásica fisioterapia salvo en casos seleccionados.
Por otro lado, cada vez se está comprobando más la existencia de debilidad muscular periférica de extremidades en estos pacientes. Programas que incluyan entrenamiento no tanto a resistencia (los clásicos) sino encaminados a mejorar la fuerza parecen ser prometedores, aunque la literatura es mucho más escasa y están por hacer. La rehabilitación trata de romper el círculo vicioso anteriormente citado de disnea, vida más sedentaria, de condicionamiento muscular y empeoramiento cada vez mayor de la disnea ante esfuerzos más pequeños. Se logra una cierta desensibilización ante la disnea, los pacientes cobran confianza en sus posibilidades, pero también se produce un efecto entrenamiento, con disminución del ácido láctico y de la ventilación necesaria para
un esfuerzo determinado y una mejoría en los enzimas oxidativos musculares, aunque esta última comprobación ha sido muy reciente y más lógica, aunque contradictoria, con algún trabajo clásico.
Los beneficios conseguidos con la rehabilitación se van perdiendo a lo largo de los meses si el sujeto no sigue ejercitándose habitualmente en su domicilio. Por eso programas domiciliarios de bajo coste, con controles periódicos una vez al mes, o su continuación tras un programa hospitalario de 2/3 meses, 3 días por semana, están claramente indicados, aunque no siempre es fácil trasladar unas cargas similares o introducir una bicicleta estática sencilla, por la falta de conocimiento y apoyo de algunas administraciones sanitarias, o la falta de disponibilidad de algunos pacientes. En el momento actual este tipo de terapéutica tan importante se les está ofertando a una mínima parte de los pacientes que se podrían beneficiar, y esa tendencia debe ir cambiando progresivamente y claramente esa es la línea desde que los servicios de neumología se están ocupando de esas parcelas. Su interés y relación coste/beneficio parecen claras y así se consideran en la mayor parte de los países desarrollados de nuestro entorno.
Oxigenoterapia domiciliaria continúa
En la enfermedad avanzada el oxígeno es necesario y junto con el tabaco son las únicas medidas que han demostrado un aumento de la supervivencia de los pacientes. Los criterios de utilización de la oxigenoterapia domiciliaria continua están bien establecidos para el paciente estable: una PaO2 menor 55mm de Hg, o entre 55 y 60 mm de Hg cuando coexistan datos de corazón pulmonar o poliglobulia secundaria con hematocrito, por encima del 55%. Si se hace una indicación de oxigenoterapia domiciliaria tras un ingreso hospitalario por reagudización, ésta debe de ser provisional y ratificarse posteriormente al menos a los tres meses y con control de gasometría arterial. El oxígeno debe de darse en los casos indicados lo más continuamente posible y al menos durante 16/18 horas por día incluyendo las horas de sueño. Usualmente deben utilizarse gafas nasales con alargadera que les permita movilizarse por la casa y la fuente más idónea domiciliaria es el concentrador, aunque siempre que sea posible son recomendables el O2 líquido con sistemas portátiles que permiten su uso fuera del domicilio. De todas formas aún sin sistemas portátiles debemos tener presente la recomendación antes hecha en el apartado de la rehabilitación y el oxígeno no debe de ser un impedimento que condicione más ataduras y una vida sedentaria para el paciente.
Las indicaciones de la oxigenoterapia domiciliaria son en general excesivas y mal hechas y lo que es aún peor los pacientes la cumplimentan muy mal si no se revisa, educa y controla con programas específicos que además son claramente rentables, aunque exigen para su puesta en marcha cierta dotación de personal y medios.
Es difícil en ocasiones romper el esquema equívoco de que el oxígeno no es para aliviar la disnea y que por tanto su uso intermitente y por cortos períodos no está indicado. Tampoco es infrecuente que un EPOC enfisematoso, muy ansioso, tenga creada una dependencia con el oxígeno a pesar de gasometrías repetidas conservadas, que nos indicarían que no lo necesitaban; en estos casos quizás puede existir una disminución de la disnea con el oxígeno, pero esta indicación no suele estar incluida en los sistemas de protección públicos ni de aseguradoras.
Otras terapéuticas: Mucolíticos y antioxidantes
La acetilcisteína, el ambroxol, e incluso el glicerol iodado han demostrado algún tipo de beneficios en este tipo de pacientes, incluso hay algunas series que apuntan a una disminución de síntomas y del número de reagudizaciones. Las normativas europea y nacional recomiendan que son precisos más trabajos para confirmar la eficacia de estos productos, su repercusión sobre las reagudizaciones, su posible influencia en la estabilidad de la función o la incidencia sobre la calidad de vida de los pacientes con EPOC. Parece razonable considerar su uso en casos individuales que refieran un beneficio claro cuando los utilizan respecto a no hacerlo.
Como pasa con las teofilinas, estos productos son sobreutilizados pero con un fácil cumplimiento por parte del paciente.
Tratamiento del corazón pulmonar
El mejor tratamiento de la hipertensión pulmonar sigue siendo la oxigenoterapia. La digital tiene poco papel en el manejo de la EPOC salvo que existan trastornos asociados (fibrilación rápida o taquicardias
supraventriculares) y los diuréticos y la sangría pueden servir en algún caso utilizados como sintomáticos en la reagudización hospitalaria. Tampoco se ha comprobado la utilidad del manejo de vasodilatadores en la EPOC.
Tratamiento con alfa1-antitripsina
Desde 1987 se cuenta con una preparación purificada de alfa1-antitripsina (prolastina) que puede aportarse a los pacientes con déficits severos. Tras su administración se alcanzan y mantienen niveles normalizados y presumiblemente protectores para evitar deterioros futuros acelerados. Existen guías para el manejo de esos casos, aunque las normativas sitúan esta terapéutica aún en el campo experimental y habrá que esperar los trabajos en curso. No debemos olvidar además su alto coste, que obliga a utilizarla bajo criterios estrictos.
Tratamiento quirúrgico: Resección de grandes bullas y cirugía reductora
Las resecciones de grandes bullas a tensión con compresión de parénquima circundante o periféricas con producción de neumotórax repetidos o extensos, son subsidiarias de cirugía, utilizándose cada vez más las técnicas videotoracoscópicas, con lo que se ha simplificado el procedimiento.
Está despertando gran expectación la reducción quirúrgica de volumen pulmonar en EPOC severo en lista de espera de trasplante, obteniéndose a corto plazo mejorías substanciales funcionales, de síntomas y capacidad de esfuerzo de los pacientes. Hay series con antigüedad, ya de 2 y 3 años y habrá que ver ya a más largo plazo en qué queda este tema. Para los interesados existen revisiones recientes sobre la cuestión.
Trasplante pulmonar
Puede ser el único tratamiento a ofertar a un paciente de EPOC muy deteriorado y con cortas expectativas de vida. El trasplante pulmón/corazón va cayendo en porcentaje en estos casos y las cifras de trasplantes uni o bipulmonar siguen creciendo con expectativas esperanzadoras. El bipulmonar puede ser necesario en los pacientes con bronquiectasias o infecciones crónicas en el pulmón residual previsto. La técnica está bien consolidada y siguen produciéndose progresos en el campo del rechazo, la terapia inmunodepresora y el tratamiento profiláctico de infecciones oportunistas. Las expectativas de vida al año rondan el 70-80% entre un
60-70% a los tres años y algo por encima del 50% a los cinco años.
En España tenemos cuatro centros realizando trasplantes pulmonares y en nuestra Comunidad Autónoma de Andalucía, el Hospital Reina Sofía de
Córdoba va cogiendo una experiencia nada desdeñable.
Indicaciones para la admisión y alta hospitalaria:
Las indicaciones principales para la hospitalización de pacientes con EPOC son las siguientes:
1. Exacerbación aguda de síntomas (disnea, tos y expectoración) que no han respondido a los cuidados ambulatorios.
2. Insuficiencia respiratoria aguda caracterizada por distrés y empeoramiento de la hipoxemia, a veces acompañada de hipercapnia con acidosis.
3. Cor pulmonale agudo con edemas periféricos, signos congestivos, empeoramiento de la capacidad de ejercicio e hipoxemia.
4. Complicaciones de la EPOC como neumonía o neumotórax, etc.
5. La necesidad de realizar procedimientos diagnósticos en el pulmón como broncofibroscopia, biopsia trasbronquial, punción de nódálos, etc, aunque este punto dependerá del estado del paciente y de la capacidad organizativa de los distintos hospitales y servicios.
6. La necesidad de cirugía o de procedimientos que requieren anestesia general.
7. Enfermedades que puedan no requerir hospitalización por ellas mismas pero que en presencia de EPOC puedan entrañar un riesgo para el paciente.
Los criterios para el alta hospitalaria serán los de mejoría del paciente hasta el punto de que sea capaz de realizar sus cuidados personales y manejar su medicación, o que estos requerimientos puedan ser seguidos convenientemente fuera del hospital.
Tratamiento hospitalario de la EPOC agudizada en fallo respiratorio agudo:
La oxigenoterapia continua a flujos bajos, preferentemente con mascarilla tipo ventimask, para mantener concentraciones más constantes, es la norma en estos casos de fallo agudo.
En pacientes hipercápnicos y con pH menor a 7.3 e inestables debe de plantearse ventilación no invasiva por vía nasal. La BiPaP y otros sistemas similares o respiradores han demostrado que se evitan intubaciones traqueales y ventilación mecánica, disminuyen la mortalidad y acortan las estancias hospitalarias. No todo tipo de paciente puede acoplarse a este tipo de ayudas, que exige además un control de enfermería estrecho en las primeras horas, por lo que hace necesario que se aplique en unidades especializadas. En pacientes con mal estado de conciencia, con muchas secreciones o sangrado activo tampoco estaría indicado. En las áreas de urgencia suele ser la presión asistencial, la masificación y la falta de habitáculos con la suficiente dignidad lo que la hacen difícilmente aplicable en nuestro medio.
Respecto a la utilización de broncodilatadores betamiméticos parece sensato su uso a dosis óptimas aumentando las de sostén y su frecuencia. En ciertos países europeos se aconseja su uso nebulizado, pero posiblemente sus efectos sean similares a los de los aplicadores unidosis, o en cámaras de inhalación que estarían especialmente indicadas en estos casos. La ATS propugna aplicaciones cada 1 ó 2 horas y control; aunque puede tener sentido un uso más frecuente (cada 4 horas) tampoco está claro que su uso más frecuente tenga valor dada la vida media de estos productos, además de los posibles efectos secundarios. Los anticolinérgicos deben usarse también a dosis altas y por vía inhalada y no parecen tener efectos indeseables. Es frecuente la utilización de aminofilina en solución intravenosa a dosis de 0.5-0.7mg/Kg/hora, con una dosis inicial de carga de 5mg/Kg para los pacientes no tratados previamente; no está claro sin embargo que el añadir xantinas aporte algo adicional al resto del tratamiento broncodilatador; puede ser aconsejable su vigilancia plasmática y la posible aparición de trastornos de la conducción aurículo ventricular y más en pacientes con fallo congestivo y daño hepático, en los que puede ser aconsejable utilizar desde el principio dosis algo más bajas.
Los broncodilatadores betamiméticos de larga duración, salmeterol, formoterol, tienen poco papel que jugar en los primeros días de una reagudización hospitalaria. Tampoco el uso de corticoides por vía inhalada.
Respecto a los corticoides, los trabajos que demuestran su eficacia añadida en las reagudizaciones son escasos. En general se aconsejan en las agudizaciones que precisan ingreso. Las dosis varían entre 0.5 mg de
metilprednisona recomendada por la ERS y la SEPAR , a las dosis más altas de 0.54 mg/Kg recomendada por la Sociedad Neumológica Australiana. Como se suele tener canalizada una vía para la simplificación de las tomas se recomienda al principio por vía endovenosa pasando a la toma oral en el curso de la mejoría.
Los antibióticos se recomiendan y nos referimos a los comentarios ya hechos para el manejo extrahospitalario, con las salvedades de la vía, que en ocasiones aconsejan la intravenosa en pacientes ventilados o con mal estado de conciencia.
La profilaxis antitrombótica es recomendada para prevenir las trombosis venosas profundas y el TEP Se utilizan heparinas de bajo peso molecular a dosis profilácticas.
El reposo es exigible en los primeros días, en posición semiincorporada pasando a sillón precozmente y a paseos con oxígeno en cuanto el estado clínico del paciente lo permita. La fisioterapia para facilitar la expectoración puede estar indicada en algunos pacientes. El uso de aerosoles con suero fisiológico pautados, sin embargo, es de una eficacia más que dudosa y con peligro de empeoramiento de la hipercapnia si se utiliza como vehículo altos flujos de oxígeno.
En plan sintomático los diuréticos pueden estar indicados en algunos casos, pero a dosis bajas y teniendo en cuenta sus efectos sobre la deplección iónica. Mejorandola oxigenación y la ventilación, los edemas van disminuyendo, y por eso este tratamiento no es algo fundamental. Poco papel le queda a la digital salvo fallo izquierdo añadido, fibrilación auricular rápida asociada o trastornos del ritmo supraventriculares. Las sangrías, aunque alguna vez pueden utilizarse, son meramente sintomáticas y tampoco se ha demostrado que tengan valor las sangrías repetidas intentando normalizar el hematocrito.
A pesar de todas las medidas citadas en algunas ocasiones el paciente sigue empeorando y acaba necesitando ventilación mecánica con intubación endotraqueal. No son fáciles en ocasiones definir la no indicación de ventilación y paso a cuidados intensivos, pues no existen criterios claros, y aunque la historia de ventilaciones previas y múltiples ingresos, una vida habitual domiciliaria muy limitada y con poca calidad de vida, una edad muy avanzada o procesos concomitantes puedan matizarlo a favor de un mantenimiento sin ventilación mecánica, ninguno de ellos son concluyentes. Si se conoce debe respetarse la voluntad del paciente. En nuestro medio más que el criterio de los pacientes, con frecuencia prima la disponibilidad de las unidades de cuidados intensivos y yo diría en algún caso una cierta prevención de los intensivistas, pues no hay duda que en algunos casos es dificultoso después el destete, prolongándose en ocasiones la ventilación, precisando traqueotomía y cuidados en ocasiones que persisten aún fuera del hospital.
Otros Tratamientos
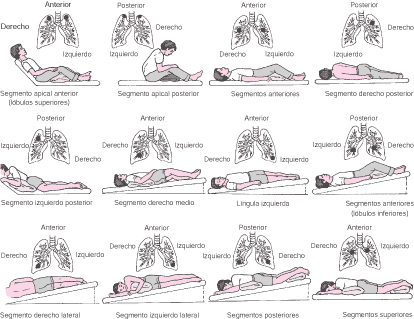
• Drenaje postural: con el objetivo de drenar las secreciones del árbol traqueóbronquial, colocando al paciente en diferentes posiciones de acuerdo al segmente bronquial a drenar para así utilizar el efecto de la gravedad.
• Técnica de espiración forzada: es el Huffing, entre otros, que consiste en una espiración forzada a glotis abierta. (soplar como intentando empañar un vidrio). También podemos nombrar la espiración con labios fruncidos, en la cual el paciente espira con los labios fruncidos, lo que produce una prolongación de la fase espiratoria y aumenta la presión dentro de las vías aéreas durante la misma, evitando así, el colapso de las vías aeres dístales.
• Técnicas de tos: tos dirigida, tos asistida, cuyo objetivo es eliminar las secreciones. Se hace asistida en casos en los que el paciente no pueda toser voluntariamente o lo haga en fora débil. El reflejo de la tos se estimula haciendo una presión a nivel de la escotadura supraesternal del paciente.
• mesoterapia de músculos inspiratorios accesorios: con el objetivo de bajar el tono de dichos músculos.
• Vibración: para favorecer la movilización de las secreciones hacia la vía aérea proximal para luego ser eliminada por medio de la tos y la expectoración.
· Percusión torácica manual (clapping): se aplican golpes rítmicos con la mano ahuecada con la intención de provocar el desprendimiento de las secreciones que puedan encontrarse impactadas en las paredes de las vías aéreas. El desprendimiento se produce por que por medio de la percusión, el flujo pasa de ser laminar a turbulento, lo cual provoca el desprendimiento de las secreciones. También se puede hacer la percusión con la mano cerrada o puño percusión interponiendo la otra mano del kinesiólogo para no percutir directamente sobre el cuerpo del paciente.
· Reeducación Respiratoria: Para disminuir el trabajo respiratorio y modificar el patrón ventilatorio para que sea más eficaz.
• Técnicas de relajación: para disminuir el trabajo respiratorio y disminuir la disnea.
• Entrenamiento físico: el ejercicio es un componente fundamental de los programas de rehabilitación porque aumenta la tolerancia al esfuerzo como efecto principal. Debe practicarse en intensidad y ambiente adecuado. Se trabaja sobre los músculos inspiratorios, extremidades superiores e inferiores y sobre la fuerza en general.
¿Cómo se puede prevenir?
Dejar de fumar trae claros beneficios, aun después de años de fumar. Cuando deja de fumar, usted desacelera el daño en los pulmones. Para la mayoría de las personas que dejan de fumar, la pérdida de la función pulmonar se desacelera y pasa a tener el mismo ritmo que la de un no fumador.
Los medicamentos disponibles en la actualidad ofrecen mucha ayuda para las personas que quieren dejar. Duplicará sus probabilidades de dejar de fumar, aunque los medicamentos sean el único tratamiento que use para dejar de fumar. Y sus probabilidades aumentan aún más si combina los medicamentos con otras estrategias para dejar de fumar, como asesoría psicológica.
Dejar de fumar es especialmente importante si usted tiene bajos niveles de proteína alfa-1 antitripsina. Las personas que tienen esto podrían reducir su riesgo de tener EPOC grave si se aplican oportunamente inyecciones de alfa-1 antitripsina que haya sido obtenida de plasma humano.
Evite el aire malo: Otros irritantes de las vías respiratorias (por ejemplo la contaminación del aire, las emanaciones químicas y el polvo) también pueden empeorar la EPOC , pero son mucho menos importantes que el hábito de fumar en lo que respecta a ser la causa de la enfermedad.
Cómo prevenir otros problemas
Vacunas contra la gripe: Si usted tiene EPOC, necesita recibir una vacuna contra la gripe cada año. Cuando las personas con EPOC tienen gripe, con frecuencia se vuelve algo más grave, como neumonía. Una vacuna contra la gripe puede ayudar a prevenir que esto suceda.
Además, es posible que aplicarse una vacuna contra la gripe regularmente reduzca sus probabilidades de tener crisis de EPOC.
Vacuna antineumocócica: Las personas con EPOC con frecuencia tienen neumonía. Aplicarse una vacuna puede ayudarle a evitar que esté muy enfermo con neumonía. Por lo general, las personas sólo necesitan una inyección, pero los médicos a veces recomiendan una segunda aplicación para algunas personas que se aplicaron su primera vacuna antes de cumplir los 65 años. Hable con su médico acerca de si usted necesita una segunda aplicación.
Puntos a recordar:
· La Enfermedad Pulmonar Obstructiva Crónica (EPOC) es un proceso que se caracteriza por una limitación permanente del flujo aéreo causada por anormalidades de las vías aéreas y del parénquima pulmonar en forma de enfisema o bronquitis crónica.
· En la EPOC se producen distintos fenómenos patológicos en cinco puntos anatómicos, resultando en varias manifestaciones clínicas: Bronquitis crónic, Bronquiolitis obstructiva, Enfisema, Enfermedad vascular pulmonar ycor pulmonales, Enfermedad sistémica.
· En más del 80% de los casos, la enfermedad está relacionada con el hábito de fumar.
· Las Causas mas comunes de esta enfermedad son: El humo del cigarrillo, La exposición laboral, éficit graves de alfa 1-antipripsina (ATT) e infecciones respiratorias.
· Para valorar la gravedad del EPOC teniendo en cuenta la presencia de síntomas y el valor de la espirometría.
· El diagnóstico de la EPOC es normalmente fácil al detectar una obstrucción poco variable tras haber descartado otros procesos.
· Dejar de fumar debe de ser la mayor prioridad en el cuidado de los pacientes con EPOC y supone la terapéutica más importante en todos los estadios y grados evolutivos de la enfermedad.
· Los broncodilatadores son el tratamiento sintomático más habitual y empleado en el manejo de la EPOC.
Donde obtener más información